猪肠道无芽孢厌氧菌定位、定量和定性的研究返回列表
目前商品肥育猪肠道无芽孢厌氧菌定位、定性、定量的研究未见报道。本研究目的调查肥育猪(长×本)肠道常见4种无芽孢厌氧菌群各自的对数均值及其包括的种,为研究猪肠道无芽孢厌氧菌对宿主的作用及其它防并对策,提高饲料利用率具有特殊的重要意义。
1、材料和方法
1.1 猪只选择和标本采集
选择成年、健康、无病、营养优良的商品肥育猪(长×本)共选10例,1月内没有使用抗生素史,体重80-90公斤,活猪急宰后,立即将空肠和直肠段封闭,运送至实验室。以无菌操作从小肠和直肠分别采集肠内容物和粪便各1克,放入盛有稀释液的试管中,经旋涡震荡器震荡5-10分钟,再作10倍递进稀释。
1.2 标本稀释、接种和培养
采集的标本,用稀释液分别稀释成10-3~10-8,然后选用适当的稀释度,分别滴种在BHI、BS、CO、LS、KV平板上,每个稀释度各滴三滴、置于Forma Anaerobic System 1028型厌氧手套箱行厌氧培养,37℃培养72小时仅仅CO平板放入国产厌氧培养箱,42℃培养72小时。观察初代培养和计数。各种特种性菌落挑取3-5接种到BHI血板上,一式二份,一份作需氧培养,另一份作厌氧培养,凡需氧和厌氧培养都生长的为兼性菌,3次以上需氧培养不生长,而厌氧培养生长的菌株定为专性厌氧菌,并作系列鉴定。
1.3 拟杆菌、乳杆菌、双歧杆菌和弯曲杆菌鉴定,包括菌落特征,菌体形态,革兰氏染色,耐氧试验和微量快速生化反应及IC分析等。
1.4 标准菌株
从中科院微生物研究所引进标准菌种,以相同方法厌氧培养48小时,取培养物10-20倍稀释后行IC分析,作为标准对照。
1.5 准脂肪酸的配制和IC分析,按《厌氧菌分离鉴定法》一书的方法配制脂肪酸,除混合标准脂肪酸外,都经10-20倍稀释后做IC分析。并作单一标准脂肪酸IC分析。
空白BHI或PYG培养的IC分析,用以校正待检菌株挥发性脂肪酸(VFA)和非挥发性脂肪酸(NVFA)的产量。
1.6 IC分析(离子色谱分析法)酸采用仪器和条件,使用成都解放仪表厂生产的SL-1型离子色谱仪。100×8mm(内径)色谱柱,分离树脂为天津化学试剂二厂生产的YSG-SO3-H+脂后填柱。洗脱液(流动相)为0.4M H3PO3和0.1M HNO3(1:1),量程2,衰减1/128,流量选择为0.6毫升/分,流量指示27毫升,低速0.2厘米/分,进样量10-20uL/次。
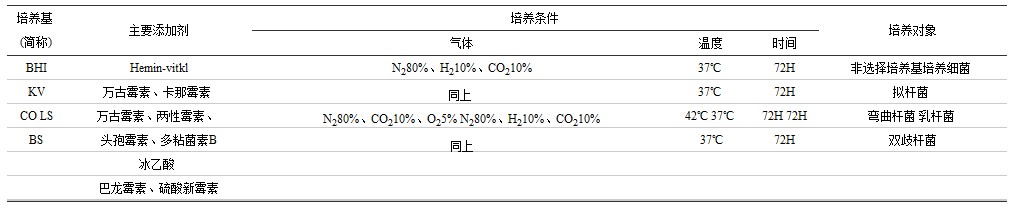
1.7 培养基及培养对象(见表1)
表1培养基及培养对象
2、结果
2.1 猪不同肠道四种厌氧菌定量结果。见表2。
表2 猪不同肠道四种厌氧菌的分离率及定量结果
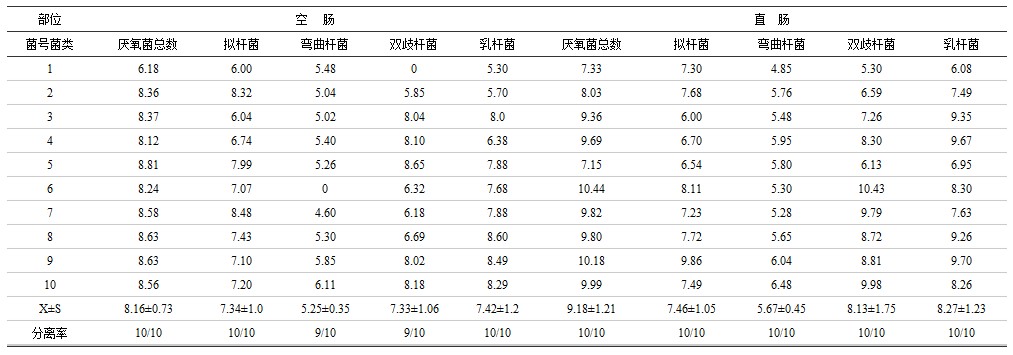
表2说明,乳杆菌(Lactobacilus),双歧杆菌(Bifido bacterium),拟杆菌(Bacteroides)和弯曲杆菌(Campylobacter)在空肠和直肠的分离率为90-100%,证明这四种菌群系猪的肠道正常菌群;厌氧菌总数在直肠为9.18±1.21,空肠为8.16±0.73,前者高于后者(P<0.01);乳杆菌和双歧杆菌的菌数均值,在直肠分别为8.27±1.23,8.13±1.75,小肠为7.42±1.2,7.33±1.06,即乳杆菌和双歧杆菌的菌数均值,直肠高于空肠(P<0.01),而拟杆菌和弯曲杆菌的菌数均值在空肠和直肠无显著差异(P>0.05)。
2.2猪肠道四种厌氧菌属分别检出种的结果见表3,4,5。弯曲杆菌在空肠10个标本中均检出空肠弯曲杆菌,在直肠10个标本中均检出结肠弯曲杆菌。
表3 猪空肠和直肠双歧杆菌种的检出的结果
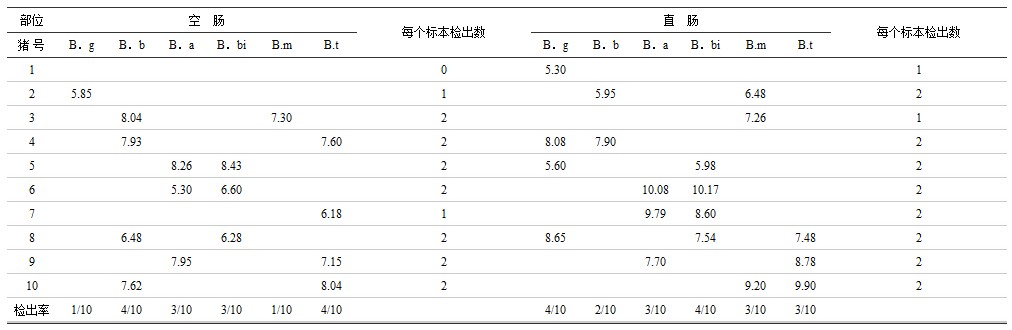
注:细菌的检出量用cfu(细菌形成单位)的对数值log10表示,表4、5相同。B.g为球双歧杆菌,B.b为短双歧杆菌,B.a为青春双歧杆菌,B.m为小双歧杆菌,B.t为嗜热双歧杆菌。
表4 猪空肠和直肠乳杆菌种的检出结果
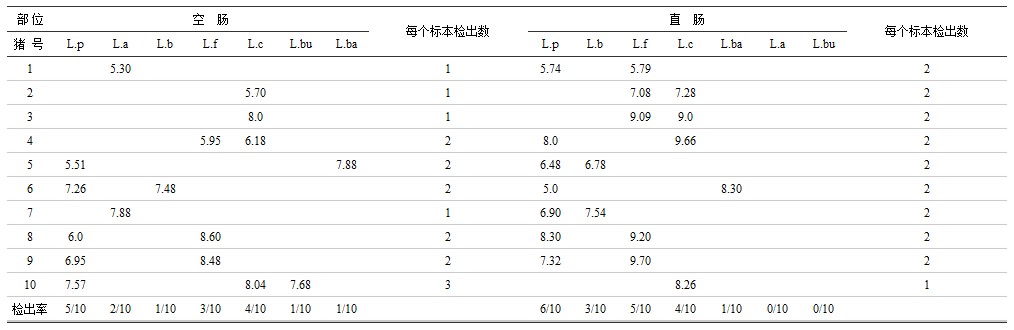
注:L.p为植物乳杆菌,L.a为嗜酸乳杆菌,L.b为短乳杆菌,L.f为发酵乳杆菌,L.c为干酪乳杆菌,L.bu为布氏乳杆菌,L.ba为保加利亚乳杆菌。
表5 猪空肠和直肠拟杆菌种的检出结果
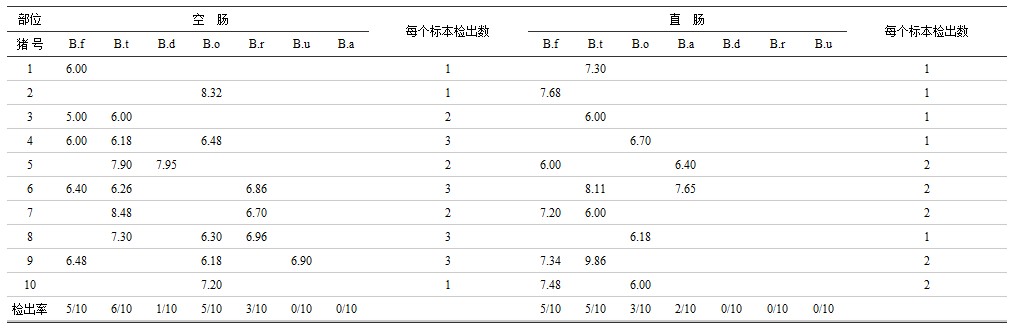
注:B.f为脆弱拟杆菌,B.t为多型拟杆菌,B.d为吉氏拟杆菌,B.o为卵型拟杆菌,B.r为栖瘤胃拟杆菌,B.u为单形拟杆菌,B.a为不解糖拟杆菌。
表3、表4、表5说明,双歧杆菌属在空肠和直肠均能检出球双歧杆菌等6个种,但检出率最高的在空肠有短双歧杆菌及嗜热双歧杆菌,直肠有球双歧杆菌及双歧双歧杆菌(检出率均为4/10)。乳杆菌属在空肠检出植物乳杆菌等7个种(共17株);直肠检出发酵乳杆菌等5个种(共19株),未检出嗜酸乳杆菌及布氏乳杆菌,检出最高的在空肠有植物乳杆菌(5/10)及干酪乳杆菌(4/10),直肠有植物乳杆菌(6/10)、发酵乳杆菌(5/10)、干酪乳杆菌(4/10)。
拟杆菌属在空肠检出多型拟杆菌等6个种(共21株)未检出不解糖拟杆菌;在直肠检出脆弱拟杆菌等4个种(共15株),未检出吉氏拟杆菌、栖瘤胃拟杆菌及单形拟杆菌;检出率最高的在空肠有多型拟杆菌(6/10),脆弱拟杆菌(5/10)及卵型拟杆菌(5/10),直肠有脆弱拟杆菌(5/10)及多型拟杆菌(5/10)。
2.3 猪肠道4种厌氧菌属代表菌株定性结果,见表6,7,8,9。
表6 猪肠道乳杆菌代表菌株定性结果
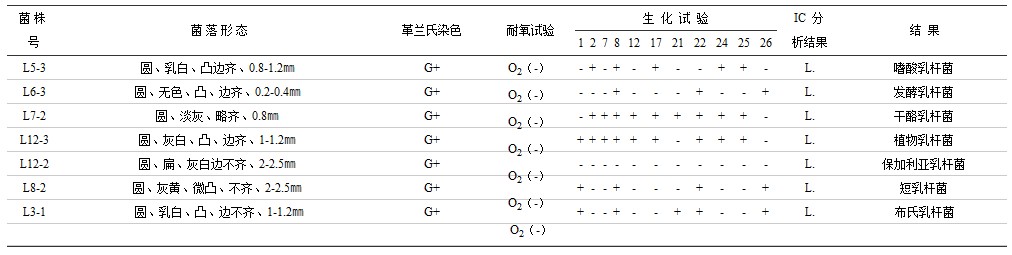
表7 猪肠道双歧杆菌代表菌株定性结果
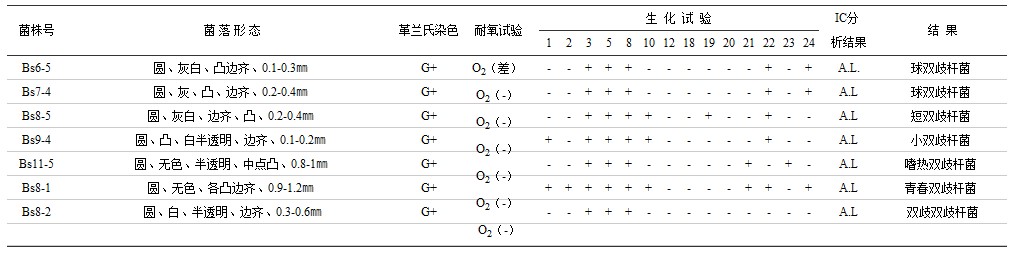
表8 猪肠道拟杆菌代表菌株定性结果
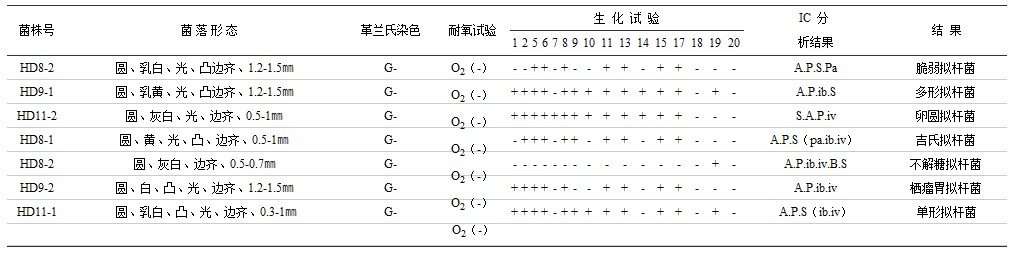
表9 猪肠道弯曲杆菌代表菌株定性结果

注:生化试验编号如下:1.阿拉伯糖 2.纤维二糖 3.半乳糖 4.甘油 5.乳糖 6.麦芽糖 7.甘露醇 8.棉子糖 9.鼠李糖 10.水杨酸 11.葡萄糖 12.山梨醇 13.蔗糖 14.罩糖 15.木糖 16.触酶 17.七叶苷水解 18.尿素酶 19.靛基质 20.硝酸盐还原 21.松三糖 22.核糖 23.菊粉 24.淀粉 25.甘露糖 26.精氨酸水解; A(乙酸)P(丙酸)iB(异丁酸)B(丁酸)iv(异戊酸)V(戊酸)L(乳酸)S(琥珀酸)F(甲酸)PA(苯丙酸)。
表6-9说明,猪肠道4种主要厌氧菌群,通过细菌菌落及菌体形态观察,微量快速的酶学生化试验,离子色谱分析厌氧菌代谢产物等法,证明在猪的肠道,乳杆菌属有嗜酸乳杆菌、发酵乳杆菌、干酪乳杆菌、植物乳杆菌、保加利亚乳杆菌、短乳杆菌及布氏乳杆菌7个种;双歧杆菌属有短双歧杆菌、嗜热双歧杆菌、青春双歧杆菌、双歧双歧杆菌、球双歧杆菌、小双歧杆菌6个种;拟杆菌属有脆弱拟杆菌、多型拟杆菌、卵型拟杆菌、栖瘤胃拟杆菌、吉氏拟杆菌、单形拟杆菌和不解糖拟杆菌7个种,弯曲杆菌属有空肠弯曲杆菌及结肠弯曲杆菌2个种。
3、结论和讨论
3.1 本研究通过定位、定量和定性调查了猪空肠和直肠每克内容物中乳杆菌、双歧杆菌、拟杆菌和弯曲杆菌四种专性厌氧菌的正常菌数及其包括的种。调查结果证明,在猪的肠道,乳杆菌属有嗜酸乳杆菌、发酵乳杆菌、干酪乳杆菌、植物乳杆菌、保加利亚乳杆菌、短乳杆菌及布氏乳杆菌7个种;双歧杆菌属有短双歧杆菌、嗜热双歧杆菌、青春双歧杆菌、双歧双歧杆菌、球双歧杆菌、小双歧杆菌6个种;拟杆菌属有脆弱拟杆菌、多型拟杆菌、、栖瘤胃拟杆菌、吉氏拟杆菌、单形拟杆菌和不解糖拟杆菌7个种,弯曲杆菌属有空肠弯曲杆菌及结肠弯曲杆菌2个种。然而他们在肠道中的定位及其所处的地位有所不同,双歧杆菌属在空肠和直肠均检出6个种,空肠内占优势的为短双歧杆菌及嗜热双歧杆菌,直肠内占优势的为球双歧杆菌及双歧双歧杆菌;乳杆菌属在空肠检出7个种,直肠检出5个种(未检出嗜酸乳杆菌及布氏乳杆菌),在空肠及直肠均占优势的为植物乳杆菌和干酪乳杆菌,唯发酵乳杆菌在直肠占优势;拟杆菌属在空肠检出6个种(为检出不解糖拟杆菌),直肠检出4个种(未检出吉氏拟杆菌、栖瘤胃拟杆菌和单形拟杆菌),在空肠及直肠均占优势的为脆弱拟杆菌及多型拟杆菌,唯卵型拟杆菌在空肠占优势。
3.2 乳杆菌、双歧杆菌、拟杆菌及弯曲杆菌的分离率:乳杆菌、拟杆菌在空肠和直肠的分离率为100%;双歧杆菌及弯曲杆菌在直肠的分离率为100%,空肠的分离率为90%;可以认为此四种菌群是猪的肠道正常菌群。这与Mitsuoka(1977)及何明清(1986)调查猪肠道的乳杆菌、双歧杆菌及拟杆菌分离率相一致,进一步证明这一判断的可靠性。该结果与何明清等(1986,1991)调查鸡、鸭肠道的乳杆菌、双歧杆菌及拟杆菌分离率相一致。但与鸡、鸭的弯曲杆菌分离率(在直肠为73-70%,空肠为80-33%),有差异。
乳杆菌等的菌数均值,在直肠:乳杆菌(8.27±1.23),双歧杆菌(8.13±1.75),拟杆菌(7.46±1.1),与何明清等(1986)调查猪直肠的乳杆菌(8.2±0.7)、双歧杆菌(8.6±0.9)相一致,但与拟杆菌(8.2±1.1)有明显差异(P<0.05)。在空肠:乳杆菌(7.42±1.2)、双歧杆菌(7.33±1.1)、拟杆菌(7.34±1.0)与何明清等(1986)调查猪空肠的双歧杆菌(7.2±0.7)相一致,但与乳杆菌(6.2±1.1)、拟杆菌(5.0±1.1)有显著差异(P<0.01)。出现上述差异的原因可能与猪的年龄有关,本次调查的猪系肥育猪,年龄在12个月以上,1986年调查的猪是仔猪日龄为1-28天。
3.3 本研究采用离子色谱分析法(IC分析法)采用细菌代谢产物结合微生物学,生化学特征鉴定所分离的细菌,其结果是可靠的,IC分析法较GLC分析法快速、敏感。







